蛋白質タンデムリピート研究
札幌医科大学医療人育成センター
教養教育研究部門物理学 松嶋範男
研究概要
蛋白質タンデムリピートの生物学
グルタミンやプロリン-グルタミンのダイペプチド、チロシン-セリン-プロリン-トレオニン-セリン-プロリン-セリン(Tyr-Ser-Pro-Thr-Ser-Pro-Ser; YSPTSPS)(RNAポリメラーゼIIの最大サブユニットのC末端に存在する)などの同じ配列あるいは互いに似た配列が連続して繰り返すアミノ酸配列(タンデムリピート)が、全蛋白質の約14%に存在している。繰り返し単位の長さは、スペクトリンのように100残基を超える場合もあり、千個以上の互いに異なるモチーフが知られている。このような蛋白質タンデムリピートの構造、機能、分子進化を理解することは、プロテオミクスやゲノミクスの観点からとても意義のある研究領域である。「タンデムリピートの生物学」の確立をめざして、我々は20年ほど前から、バイオインフォマテクス、核磁気共鳴法(NMR)、X線小角散乱法(SAXS)などの分光測定によりタンデムリピートの立体構造や分子進化の研究を進めている。
Leucine-rich Repeat(LRR))蛋白質の研究
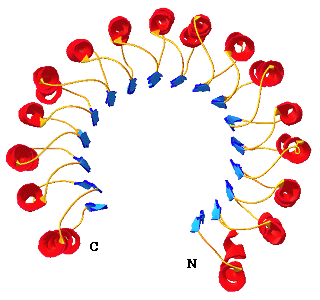
ロイシン・リッチ・リピート(LRR)は、ロイシンを主に疎水性残基を規則的に含む20~30残基の長さを一単位として連続して繰り返すタンデムリピートである。LRRを含む蛋白質(LRR蛋白質)は、ウイルスからヒトまで6万個を超えている。このようなLRR蛋白質は、自然免疫、病原体の抵抗性、細胞接着、DNAの修復などのさまざまな機能発現に密接に関連している。Toll-like receptorファミリーは、リポサッカライドなどのさまざまなリガンドとの相互作用をとうして、自然免疫のシステムに関連することが示され、ホットな研究領域となっている。 リボヌクレアーゼインヒビター(Ribonuclease inhibitor, RI)は分子全体が15回繰り返したLRRからなる。Cはシステイン)からなる。このRIの立体構造が、LRR蛋白質として最初に解かれたものであり、、分子全体が馬蹄形をしていることが明らかにされた。馬蹄形の内側はβ -シート(青色)が積み重なり、一方外側はα-へリックス(赤色)が積み重なっている(右図)。
Leucine-rich Repeat(LRR))の構造、機能、分子進化を明らかにすべく研究を進めている。これまで、Bioinfornmaticsのアプローチにより、LRRの超周期の解析、LRR蛋白質の既知構造の定量的解析、Toll-like receptor ファミリーのLRR解析を行っている。最近LRRアイランドドメインの解析を進めている。
- Norio Matsushima and Hiroki Miyashita “Leucine-Rich Repeat (LRR) Domains Containing Intervening Motifs in Plants” (Review) Biomolecules, 2012, 2: 288-311.
- Tomoko Mikami, Hiroki Miyashita, Shintaro Takatsuka, Yoshio Kuroki, and Norio Matsushima “Molecular evolution of vertebrate Toll-like receptors: Evolutional rate difference between their leucine-rich repeats and TIR domains” Gene, 2012,503(2):235-243.
- Matsushima N., Miyashita H., Mikami T., Yamada K. “A new method for the identification of leucine-rich repeats by incorporating protein second struture prediction” Bioinformatics: Genome Bioinformatics and Computational Biology, (Tuteja R. editor); NOVA Sience Pulishers, pp.61-88, 2011.
- Matsushima N,Miyashita H, Mikami T, Kuroki Y. “A nested leucine rich repeat (LRR) domain: The precursor of LRRs is a ten or eleven residue motif. BMC Microbiology (2010) 10:235-244.
- Matsushima N, Mikami T, Tanaka T, Miyashita H, Yamada K, Kuroki Y. “Analyses of Non-Leucine Rich Repeat (Non-LRR) Regions Intervening Between LRRs in Proteins” Biochim Biophys Acta. 1790(10):1217-1237 (2009)
- Matsushima N, Tanaka T, Enkhbayar P, Mikami T, Taga M, Yamada K, Kuroki Y. Comparative sequence analysis of leucine-rich repeats (LRRs) within vertebrate toll-like receptors. BMC Genomics. 8:124-143 (2007).
- Kim HM, Park BS, Kim JI, Kim SE, Lee J, Oh SC, Enkhbayar P, Matsushima N, Lee H, Yoo OJ, Lee JO. Crystal structure of the TLR4-MD-2 complex with bound endotoxin antagonist Eritoran. Cell. 130(5):906-917 (2007)
- Matsushima N, Tachi N, Kuroki Y, Enkhbayar P, Osaki M, Kamiya M, Kretsinger RH. Structural analysis of leucine-rich-repeat variants in proteins associated with human diseases. Cell Mol Life Sci. 62(23):2771-2791 (2005)
- Matsushima N, Enkhbayar P, Kamiya M, Osaki M, Kretsinger RH. Leucine-rich repeats (LRRs): structure, function, evolution and interaction with ligands” Drug Design Reviews 2 (4): 305-322 (2005)
- Enkhbayar,P, Kamiya,M., Osaki,M., Matsumoto,T,, Matsushima,N. :Structural principles of Leucine-rich repeats (LRR) proteins. Proteins; Struc. Func. Bioinform., 54:394-403 (2004)
- Matsushima, N., Kamiya, M., Suzuki, N., and Tanaka, T. “Super-motifs of leucine-rich repeats (LRRs) proteins” Genome informatics 11:343-345 (2000)
- Matsushima, N., Ohyanagi, T., Tanaka, T. and Kretsinger, R. H. “Super-motifs and evolution of super-motifs of tandem leuine-rich repeats within small proteoglycans—biglycan, decorin, lumican, fibromodulin, PRELP, keratocan, epiphycan, and osteoglycin ” Proteins; structure, function and genetics, 38:210-225 (2000).
Non-globular Structuresの蛋白質タンデムリピートの研究
多くのタンデムリピートの立体構造が、X線結晶構造解析やNMR解析により明らかにされてきている。それらは亜鉛フィンガー、EFハンド、WDリピートなどのようにそれぞれが安定な球状構造をとる場合と、ロイシンリッチリピート(LRR)、アンキリン、HEAT、armadilloなどのようにラセン構造がコイルしたスーパーヘリックス構造(ソレノイド構造)をとる場合がある。一方、これらの構造クラスとは異なる構造をとる一群のタンデムリピートが存在する。これらのタンデムリピートは、生理学的条件下でフレキシブルな構造あるいはランダムな構造をとる。また、銅イオンやカルシウムイオンなどの無機イオン、蛋白質とも相互作用する。
これまで、コンピュータグラフィックスを利用したタンデムリピートのモデリング研究、、NMR、SAXS、CDなどの分光測定によるタンデムリピートの合成ペプチドを用いた立体構造、銅イオンとの相互作用の研究を研究を進めている。
蛋白質タンデムリピートの構造研究
氷核蛋白質タンデムリピートの立体構造:農産物に被害を与える天災の一つとしての霜害は、地表温度が-2℃前後といった温和な条件下で凍結してしまうことにより起こる。この霜は、氷核活性細菌によるものであることが明らかにされている。この氷核活性細菌の表面には、水が凍ることを促進する氷核蛋白質が存在し、この氷核蛋白質により、細胞外での水の凍結を促進し、細菌は自らの細胞内での致命的な凍結を防いでいる。この氷核蛋白質は、オクタペプチド、Ala-Xaa-Xaa-Xaa-Ser-Xaa-Xaa-Xaa (Xaa は任意のアミノ酸)が、100回以上も連続して繰り返すタンデムリピートを含む。24残基からなる塩基性のペプチドのNMR解析を行い、LTAGYがループ構造をとることを明らかにした。さらに、チロシンの芳香環側鎖がアルギニン側鎖と互いに近いことが示された。
植物グリシンリッチ蛋白質に存在するタンデムピートと銅イオンとの結合、プリオン蛋白質のオクタペプチドリピートの立体構造、植物貯蔵蛋白質グルテンおよびα-zeinのよう溶液X線小角散乱(SAXS)により構造研究も行っている。
- Matsushima N, Tanaka T, Kretsinger RH. Non-globular structures of tandem repeats in Proteins. Protein & Peptide Letters, 16(11): 1297-1322 (2009).
- Matsushima N, Yoshida H, Kumaki Y, Kamiya M, Tanaka T, Izumi Y, Kretsinger RH. Flexible structures and ligand interactions of tandem repeats consisting of proline, glycine, asparagine, serine, and/or threonine rich oligopeptides in proteins. Curr Protein Pept Sci. 9(6):591-610 (2008).
- Matsushima N, Tanaka T, Kretsinger RH. Non-globular structures of tandem repeats in Proteins. Protein & Peptide Letters, in preparation.
- Matsushima N, Yoshida H, Kumaki Y, Kamiya M, Tanaka T, Izumi Y, Kretsinger RH. Flexible structures and ligand interactions of tandem repeats consisting of proline, glycine, asparagine, serine, and/or threonine rich oligopeptides in proteins . Current Protein and Peptide Science. in press.
- Kumaki Y, Kawano K, Hikichi K, Matsumoto T, Matsushima N. A circular loop of the 16-residue repeating unit in ice nucleation protein. Biochem Biophys Res Commun. 371(1):5-9 (2008)
- Kamiya M, Kumaki Y, Nitta K, Matsumoto T, Hikichi K, Matsushima N. The binding of copper ions to glycine-rich proteins (GRPs) from Cicer arietinum. Biochim Biophys Acta. 1722(1):69-76 (2005)
- Kumaki,K., Nitta,K., Hikichi,K., Matsumoto,T., Matsushima,N. :Side chain-side chain interactions of arginine with tyrosine and aspartic acid in Arg/Gly/Tyr-rich domains within plant glycine-rich RNA binding proteins. J. Biochem., (Tokyo) 136:29-37 (2004)
- Kamiya,M., Kumaki,Y., Nitta,K., Ueno,T., Watanabe,Y., Yamada,K., Matsumoto,T., Hikichi,K., Matsushima,N.: Copper binding to plant ozone-inducible proteins (OI2-2 and OI14-3). Biochim. Biophys. Res. Commun., 314:908-915(2004)
- Kumaki Y, Matsushima N, Yoshida H, Nitta K, Hikichi K. Structure of the YSPTSPS repeat containing two SPXX motifs in the CTD of RNA polymerase II: NMR studies of cyclic model peptides reveal that the SPTS turn is more stable than SPSY in water. Biochim Biophys Acta. 2001 Jul 9;1548(1):81-93.
- Yoshida H, Matsushima N, Kumaki Y, Nakata M, Hikichi K. NMR studies of model peptides of PHGGGWGQ repeats within the N-terminus of prion proteins: a loop conformation with histidine and tryptophan in close proximity. J Biochem. 2000 Aug;128(2):271-81.
- Matsushima N, Izumi Y, Aoba T. Small-angle X-ray scattering and computer-aided molecular modeling studies of 20 kDa fragment of porcine amelogenin: does amelogenin adopt an elongated bundle structure? J Biochem. 1998 Jan;123(1):150-6.
- Tsuda S, Ito A, Matsushima N. A hairpin-loop conformation in tandem repeat sequence of the ice nucleation protein revealed by NMR spectroscopy. FEBS Lett. 1997 Jun 9;409(2):227-31.
- Medvedkin VN, Permyakov EA, Klimenko LV, Mitin YV, Matsushima N, Nakayama S, Kretsinger RH. Interactions of (Ala*Ala*Lys*Pro)n and (Lys*Lys*Ser*Pro)n with DNA. Proposed coiled-coil structure of AlgR3 and AlgP from Pseudomonas aeruginosa. Protein Eng. 1995 Jan;8(1):63-70.
- Matsushima N, Danno G, Takezawa H, Izumi Y. Three-dimensional structure of maize alpha-zein proteins studied by small-angle X-ray scattering. Biochim Biophys Acta. 1997 Apr 25;1339(1):14-22.
- Matsushima N, Danno G, Sasaki N, Izumi Y. Small-angle X-ray scattering study by synchrotron orbital radiation reveals that high molecular weight subunit of glutenin is a very anisotropic molecule. Biochem Biophys Res Commun. 1992 Jul 31;186(2):1057-64.
- 松嶋範男 ”タンパク質の反復アミノ酸配列の立体構造予測-コンピュ-タグラフ ィックスの利用-” 生物物理 、Vol. 31, No. 3, pp115-120, 1991
- Matsushima N, Creutz CE, Kretsinger RH. Polyproline, beta-turn helices. Novel secondary structures proposed for the tandem repeats within rhodopsin, synaptophysin, synexin, gliadin, RNA polymerase II, hordein, and gluten. Proteins. 1990;7(2):125-55.
カルモジュリンの溶液構造, 構造変化の研究
- Nayashi N., Takeuch M., inbo Y., Matsushima, N., Izumi, Y., “Tertiary Structure of Calmodulin Predicted by Bioinformatics: Experimental Verification by SAXS (3)” Photon Factory Activity Report, in press.
- Matsushima N, Hayashi N, Watanabe N, Jinbo Y, Izumi Y. Binding of trifluoperazine to apocalmodulin revealed by a combination of small-angle x-ray scattering and nuclear magnetic resonance. J. Appl. Crystallogr. 40: s179-s183 (2007)
- Izumi, Y., Goto, K., Jinbo Y., Takezawa, D., Nayashi N., Matsushima, N., “Solution Structure of Plant Calmodulin in the Absence and Presence of Targets: Implications on its Structure and Function” Photon Factory Activity Report, (2006) 24 (B), 238-238.
- Izumi, Y., Nayashi N., Jinbo Y., Matsufuji T., Matsushima, N., “Tertiary Structure of Calmodulin Predicted by Bioinformatics: Experimental Verification by SAXS (2)” Photon Factory Activity Report, (2006) 24(B), 221-221.
- Izumi, Y., Nayashi N., Jinbo Y., Matsufuji T., Matsushima, N., “Tertiary Structure of Calmodulin Predicted by Bioinformatics: Experimental Verification by SAXS“ Photon Factory Activity Report, (2006) 24(B), 215-215.
- Hayashi N, Nakagawa C, Ito Y, Takasaki A, Jinbo Y, Yamakawa Y, Titani K, Hashimoto K, Izumi Y, Matsushima N. Myristoylation-regulated direct interaction between calcium-bound calmodulin and N-terminal region of pp60v-src. J Mol Biol. 2004 Apr 16;338(1):169-80.
- Hayashi N, Matsubara M, Jinbo Y, Titani K, Izumi Y, Matsushima N. Nef of HIV-1 interacts directly with calcium-bound calmodulin. Protein Sci. 2002 Mar;11(3):529-37.
- Hayashi N, Izumi Y, Titani K, Matsushima N. The binding of myristoylated N-terminal nonapeptide from neuro-specific protein CAP-23/NAP-22 to calmodulin does not induce the globular structure observed for the calmodulin-nonmyristylated peptide complex. Protein Sci. 2000 Oct;9(10):1905-13.
- Matsushima N, Hayashi N, Jinbo Y, Izumi Y. Ca2+-bound calmodulin forms a compact globular structure on binding four trifluoperazine molecules in solution. Biochem J. 2000 Apr 1;347 Pt 1:211-5.
- Osawa M, Kuwamoto S, Izumi Y, Yap KL, Ikura M, Shibanuma T, Yokokura H, Hidaka H, Matsushima N. Evidence for calmodulin inter-domain compaction in solution induced by W-7 binding. FEBS Lett. 1999 Jan 15;442(2-3):173-7.
- Matsuda S, Izumi Y, Matsushima N. Small angle X-ray scattering study of S100 proteins. Biochem Mol Biol Int. 1993 Jul;30(3):419-24.
- Izumi Y, Wakita M, Yoshino H, Matsushima N. Structure of the proteolytic fragment F34 of calmodulin in the absence and presence of mastoparan as revealed by solution X-ray scattering. Biochemistry. 1992 Dec 8;31(48):12266-71.
- 和泉義信、松嶋範男、能野秀典 “多機能蛋白質:カルモデュリンの酵素活性化の 作用発現機構―X線溶液散乱からのアプローチ” 放射光、Vol.2, No.1, pp. 23-33, 1989
- Yoshino H, Minari O, Matsushima N, Ueki T, Miyake Y, Matsuo T, Izumi Y. Calcium-induced shape change of calmodulin with mastoparan studied by solution X-ray scattering. J Biol Chem. 1989 Nov 25;264(33):19706-9.
- Matsushima N, Izumi Y, Matsuo T, Yoshino H, Ueki T, Miyake Y. Binding of both Ca2+ and mastoparan to calmodulin induces a large change in the tertiary structure. J Biochem. 1989 Jun;105(6):883-7.
骨微細組織の研究
- 松嶋範男、“骨ミネラルのX線小角散乱” 日本バイオレオロジー学会誌、 (2004) 18 (3):32-36.
- Sasaki N, Shukunami N, Matsushima N, Izumi Y. Time-resolved X-ray diffraction from tendon collagen during creep using synchrotron radiation. J Biomech. 1999 Mar;32(3):285-92.
- Matsushima N, Hikichi K. Age changes in the crystallinity of bone mineral and in the disorder of its crystal. Biochim Biophys Acta. 1989 Aug 18;992(2):155-9.
- Sasaki N, Matsushima N, Ikawa T, Yamamura H, Fukuda A. Orientation of bone mineral and its role in the anisotropic mechanical properties of bone--transverse anisotropy. J Biomech. 1989;22(2):157-64.
- Matsushima N, Tokita M, Hikichi K. X-ray determination of the crystallinity in bone mineral. Biochim Biophys Acta. 1986 Oct 1;883(3):574-9.
- Sasaki N, Yamamura H, Matsushima N. Is there a relation between bone strength and percolation? J Theor Biol. 1986 Sep 7;122(1):25-31.
- Matsushima N, Akiyama M, Terayama Y, Izumi Y, Miyake Y. The morphology of bone mineral as revealed by small-angle X-ray scattering. Biochim Biophys Acta. 1984 Sep 28;801(2):298-305.
- Matsushima N, Akiyama M, Terayama Y. “Quantitative Analysis of the Orientation of Mineral in Bone from Small-Angle X-Ray Scattering Patterns” Japanese J. Appl. Phys. Vol. 21, No. 1, pp. 186-189 (1982)
- Matsushima N, Akiyama M, Terayama Y. “Quantitative Analysis of Small-Angle X-Ray Scattering of Bone: Determination of Sizes of Its Collagen and Apatite Components” Japanese J. Appl. Phys. Vol. 20, No. 4, pp. 699-702 (1981)
合成ポリペプチドの固体物性
- Hikichi K, Matsushima N, Mizuno T. “Radial Distribution Studies of Poly(γ-benzyl-L-glutamate) Film” Repts. Progr. Polym. Phys. Jpn. Vol. 22, pp. 557-558 (1979)
- Matsushima N, Hikichi K. “X-Ray Scattering of Synthetic Poly(α-amino acid)s in the Solid State. V. An Analysis of Poly(γ-methyl-L-glutamate) and Poly(γ-benzyl-L-glutamate) by a Coaxial Two Phase Model of Diffraction Intensity” Polymer Journal, Vol. 10, No. 4, pp. 437-441 (1978)
- Matsushima N, Hikichi K. “X-Ray Scattering of Synthetic Poly(α-amino acid)s in the Solid State. IV. Transition of Poly(γ-benzyl-D-glutamate) in the β-Form” Polymer Journal, Vol. 9, No. 4, pp. 391-394 (1977)
- Matsushima N, Hikichi H. “X-Ray Scattering of Synthetic Poly-α-amino Acids in the Solid State. Thermal Motions of Poly-γ-benzyl-D-glutamate in High Temperature Region” Repts. Progr. Polym. Phys. Jpn. Vol. 20, pp. 585-586 (1977)
- Matsushima N, Shiwa S, Hikichi K. “On Unindexed Meridional Reflection of Poly-α-amino Acids in the α-Helical Conformation” Repts. Progr. Polym. Phys. Jpn. Vol. 20, pp. 583-584 (1977)
- Hikichi K, Tanemoto H, Matsushima N, Tsutsumi A, Kaneko M. “Chain Packing of Copoly(γ-methyl, γ-benzyl-D-glutamate)s in the Crystal” Repts. Progr. Polym. Phys. Jpn. Vol. 19, pp. 511-512 (1976)
- Matsushima N, Hikichi K, Tsutsumi A, Kaneko M. “X-Ray Scattering of Synthetic Poly(α-amino acid)s in the Solid State. III. Temperature Dependence of the 1.5A-Meridional Reflection of the α-Helix” Polymer Journal, Vol. 8, No. 1, pp. 88-95 (1976)
- Matsushima N, Hikichi K, Tsutsumi A, Kaneko M. “X-Ray Scattering of Synthetic Poly(α-amino acid)s in the Solid State. II. Phase Transition of DL Mixtures of Poly(γ-benzyl-L-glutamate)s” Polymer Journal, Vol. 7, No. 3, pp. 382-386 (1975)
- Matsushima N, Hikichi K, Tsutsumi A, Kaneko M. “X-Ray Scattering of Synthetic Poly(α-amino acid)s in the Solid State. I. Transition of Poly(γ-benzyl-L-glutamate) and Poly(γ-methyl-L-glutamate)” Polymer Journal, Vol. 7, No. 1, pp. 44-49 (1975)
- Tsutsumi A, Hikichi H, Takahashi T, Yamashita Y, Matsushima M, Kanke M, Kaneko M. "Relaxation Phenomena of Poly-γ-benzyl-L-glutamate, Poly-γ-methyl L-glutamate, and Copoly(γ-methyl-L-glutamate, γ-benzyl-L-glutamate)" J. Macromol. Sci.-Phys., Vol. B8(3-4), pp. 413-430 (1973)